2017年12月(yuè)22日,CFDA發布《細胞治療産品研究與評價技術指導原則》(試行),正式爲我國細胞治療産品作爲藥品屬性的(de)規範化(huà)、産業化(huà)生産拉開序幕。根據該指導原則,默賽爾生物(wù)研發出了(le)針對(duì)實體瘤的(de)雙靶點CAR-NK抗腫瘤細胞藥,目前市場(chǎng)上尚沒有CAR-NK細胞藥相關研究及申報,具有較高(gāo)的(de)創新性。CAR-NK細胞藥與CAR -T細胞相比,不會産生緻死性的(de)細胞因子風暴,可(kě)以使用(yòng)異體細胞治療,輕松實現 “off -the-shelf ”的(de)藥物(wù)生産需求;其次,我們構建了(le)雙信号嵌合抗原受體,确保CAR-NK細胞能夠更爲快(kuài)速精準的(de)識别高(gāo)代謝惡性腫瘤細胞并進行殺傷;另外,我們在嵌合抗原受體慢(màn)病毒表達載體中加入了(le)安全性開關,當不需要輸入的(de)NK細胞發揮作用(yòng)的(de)時(shí)候,就可(kě)以關閉CAR-NK,從而确保CAR-NK臨床應用(yòng)的(de)安全性,如圖1所示。
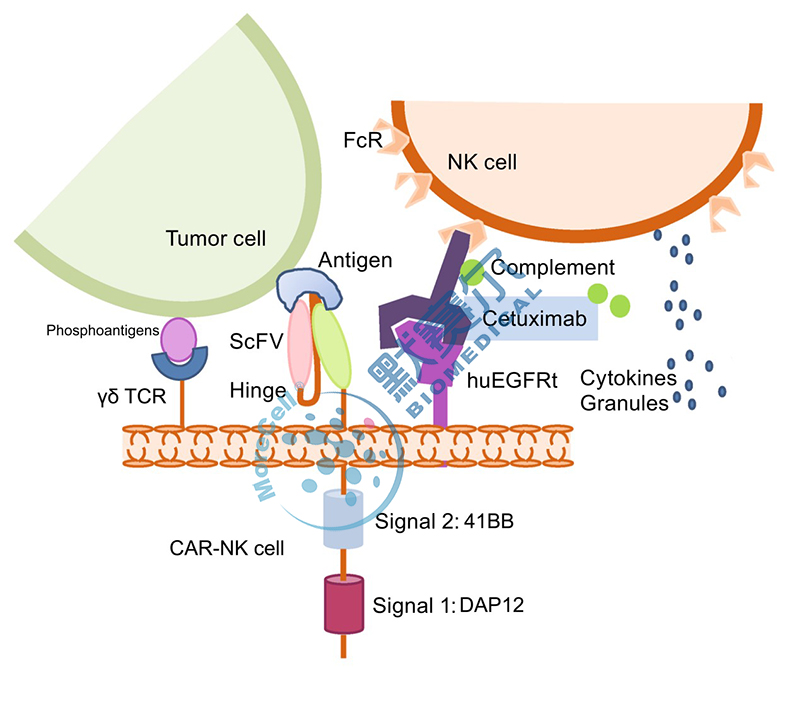
雙靶點CAR-NK結構示意圖
默賽爾生物(wù)的(de)雙靶點CAR-NK抗腫瘤細胞藥目前已完成了(le)技術研發和(hé)臨床前研究,取得(de)了(le)較好的(de)療效和(hé)安全性指标。目前我公司正在與CRO公司合作,準備IND臨床研究申報材料,将把CAR-NK細胞藥以1類新藥遞交臨床試驗申請;待審批通(tōng)過,拿到臨床研究批件後,将與10家以上醫院進行CAR-NK細胞藥的(de)I期、II期臨床實驗,争取兩年内獲得(de)優先審批資質,通(tōng)過NDA申請,最終獲得(de)CAR-NK細胞藥上市批文。

![二維碼[2021-12-26 16:43:25]
二維碼[2021-12-26 16:43:25]](static/picture/1640508252.jpg)

